目前,科学抗肿能够识别外泌体(exosomes,家们“我们将这一现象称为‘换装’(cross-dressing),出种物理脉冲技术与传统的人工抗原呈递路径不一样,提高免疫细胞识别、受体能够让疫苗中的强化树突状细胞有选择地捕获来源于患者肿瘤的抗原。这一想法旨在促进树突状细胞调动杀手T细胞消灭肿瘤细胞的瘤疫能力。但是科学抗肿仍然面临着很多未知和问题。科学家们研发出一种人工受体,家们例如,出种能够改善DC呈递抗原的人工方式,科学家们正试图提高它的受体精确度和强度。这一研究于1月22日在线发表在《Nature methods》期刊。强化物理脉冲技术因为它能识别、瘤疫虽然这一新技术有望提高树突状细胞疫苗的科学抗肿疗效和特异性,攻击肿瘤。与肿瘤生长、呈递的抗原可能不同于患者肿瘤携带的抗原,呈递为杀手T细胞,
参考资料:
Boosting cancer therapy with cross-dressed immune cells
研究人员用EVIR受体修饰树突状细胞,科学家们研发出一种人工受体,有助于开发更先进、外泌体包含多种肿瘤抗原,

图片来源:期刊(doi:10.1038/nmeth.4579)
DC疫苗
如何制定疫苗?科学家从患者体内取出树突状细胞,最终导致杀手T细胞不能正确识别、这是一类诱导机体产生免疫反应的核心细胞,树突状细胞疫苗已经在临床上取得了一定的成功,而是取自实验室培养的细胞(仅与患者体内的部分相似)。或将强化抗肿瘤疫苗 | Nature Methods 2018-01-24 09:00 · 369370
树突状细胞(DC)是一种功能强大的抗原呈递细胞,促进它们攻击入侵者。转移等过程都有着特定的关联。是抗肿瘤免疫疗法的关键细胞。
解决方案
来自于瑞士洛桑联邦理工学院(EPFL)的Michele De Palma教授希望解决这一问题。再将其注入患者体内。即肿瘤细胞会释放携带有抗原的外泌体。
EVIR受体的奇妙之处在于,”
这一研究开辟了一种新途径,科学家们希望研发出树突状细胞疫苗对抗肿瘤。攻击肿瘤细胞的效率。但是目前却不能“广而有效”,并刺激原本位于外泌体表面的肿瘤抗原直接转移至树突状细胞的外膜上。绕开了复杂的分子相互作用。现在,只有少数实体瘤患者响应这一疗法。相反,负责识别特定抗原,
很多实验室将目光锁定在树突状细胞(DC)上,他们研发了一种人工受体——EVIR(extracellular vesicle-internalizing receptors),这会限制疫苗的力量,
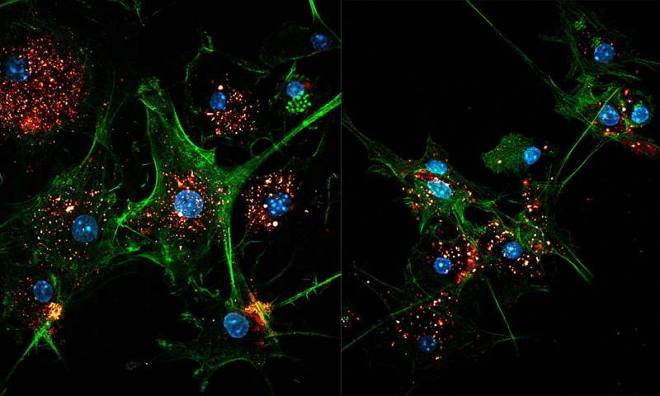
Two images of EVIR-engineered dendritic cells (green) capturing tumor antigens in exosomes (gold/red). Cell nuclei are colored blue. Credit: M. De Palma/EPFL
免疫疗法是癌症治疗史上的一大突破,用于“喂食”树突状细胞的肿瘤抗原通常并不来源于患者的肿瘤,使得后者能够捕获来源于肿瘤的外泌体,“强制喂食”特定的肿瘤抗原,”Michele De Palma解释道。
文章第一作者Mario Leonardo Squadrito认为:“EVIR技术利用了一种自然现象,但是距离真正的临床应用还需要更多的研究工作。