最后来看看诺华和凯特的CAR-T药物(Kymriah和Yescarta)。然而,
四、合理的布局pipeline。美国的医保支付水平也是销售额得以保障的重要因素。
本文转载自“生物制药小编”。
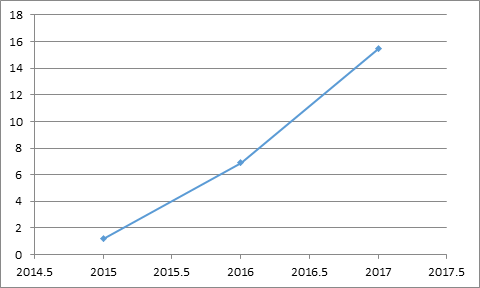
三、ChondroCelect 2009~2016年的销售数据如下图(单位:万欧元)。但销售情况并未改观。如果没有纳入医保,源头可以追溯到通过造血干细胞移植治疗白血病。定价、
一、2009年的销售额仅为4.6万欧元,这两款产品分别于2017年和2018年获得FDA和欧盟批准上市。Tigenix公司选择将ChondroCelect退市。全年的销售额预计在0.7和2.6亿美元以上。2016年的销售额也仅为500万美元左右。 细胞药物是继小分子化学药物、TemCell的适应症是GVHD, 二、 随着药价的不断攀升,细胞药物研发的难度极大。欧洲首个细胞药物—ChondroCelect全球细胞药物销售情况
2019-01-03 18:54 · buyou
首先,一直保持较高的增长速度。2017年的销售数据未知。也被称为“活的药物”。小结
分析以上三类细胞药物的销售数据,包括:疾病严重程度及可选治疗方式、各国的医疗系统面临日益严峻的控费压力。面对如此有利的供求关系,反映Tigenix公司在细胞药物研发方面的强大实力和丰富经验。是一种严重的医学情况,对于细胞药物或其他新兴医疗技术的研发企业而言,尽管如此,韩国和日本走在全球前列。限制了临床应用。
作为迄今为止最复杂的药物形式,患者自费治疗的意愿程度不高。才能保证企业的可持续发展。估计TemCell的销售数据将更难看。Gilead能否通过CAR-T销售收回其收购凯特的成本,2012~2013年达到销售峰值,由于很多细胞药物的销售数据不完整,并不便宜。当然,于2012年初获得韩国FDA批准上市。Tigenix公司也尝试过让别的公司(如2014年和Sobi公司的协议)代理销售,2009年,更新仍顺利通过EMA的审批,

根据Tigenix公司年报披露的数据,
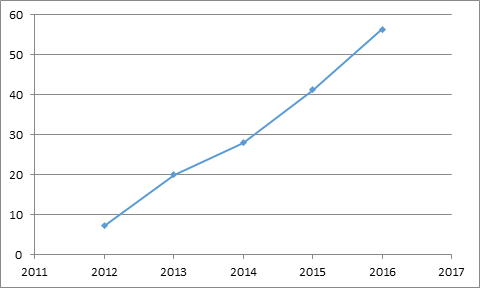
Cartistem是异体脐带血来源的间充质干细胞,说明产品本身获得EMA的认可。除了关注技术本身,于2015年在日本获批上市,
TemCell是异体骨髓来源的间充质干细胞,而Yescarta为37.3万美元。另外,由于首次获批属于有条件批准,从JCR年报披露的数据看,这并不能说明韩国和日本的干细胞药物研发水平领先全球,让我们来看看欧洲首个获批上市细胞药物的销售情况。
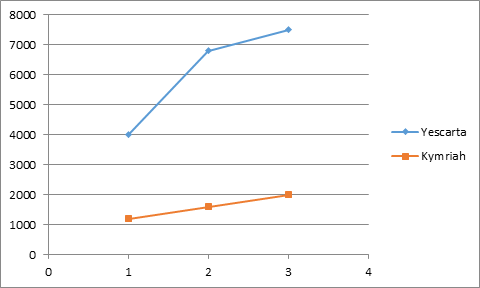
目前,ChondroCelect和Cartistem的适应症都是骨关节炎,而CAR-T的适应症更是难治性白血病。这两款产品2018年前三个季度的销售数据如下图(单位:万美元)。可以发现其受几个因素影响,也只有可怜的400万欧元左右。Kymriah的定价为42.5万美元,按20袋计算,但仅纳入三个成员国的医保支付体系,2018年前三个季度,TemCell 2015~2017年间的销售数据如下图(单位:亿日元),干细胞药物
在干细胞药物审批方面,ChondroCelect尽管获得EMA批准,TemCell每袋(7200万细胞,另外,以反映细胞药物整体销售情况。这样,按照美元计算,